[중등2과학]염류와 염분(염분비일정 법칙)
자. 이번 수업은 염류와 염분에 대해 알아보자.
염류는 해수에 녹아 있는 여러가지 물질을 말하며
짠맛을 내는 염화나트륨이 가장 많고
쓴맛을 내는 염화마그네슘이 두번째로 많은 양을 차지하고 있다.
염분은 해수 1000g에 녹아 있는 염류의 질량을 g수로 나타낸 것을 말하며
단위는 실용염분단위인 psu나 퍼밀을 사용한다.
전 세계 해수의 평균 염분은 35psu인데
이것은 해수 1000g에 염류가 35g 녹아 있다는 말이고
물 965g에 염류 35g을 녹이는 것으로
같은 염분의 해수를 만들수 있다는 의미이다.
해수의 염분은
증발량과 강수량, 담수 유입량, 해빙과 결빙에 따라 다르게 나타난다.
증발량이 강수량보다 많은 지역에서는 염분이 높게 나타나고
증발량이 강수량보다 적은 지역에서는 염분이 낮게 나나타며
육지로부터 담수가 많이 들어오는 지역은 염분이 낮다.
얼음이 녹는 지역은 염분이 낮아지고
얼음이 어는 지역은 염분이 높아진다.
위도별 염분 분포를 살펴보면
저위도 지역은 비가 많이 내리므로
강수량이 증발량보다 많아 염분이 낮고
중위도 지역은 건조한 기후에 의해
증발량이 강수량보다 많아 염분이 높으며
고위도 지역은 빙하가 녹기 때문에
염분이 낮게 나타난다.
또한 우리나라는 강수량이 많은 여름철이 겨울철보다 염분이 낮으며
강물이 많이 유입되는 황해의 염분이 동해의 염분보다 낮게 나타난다.
다음은 염분비 일정 법칙에 대해 알아보자.
염분비 일정 법칙은
지역이나 계절에 따라 염분이 다르게 나타나더라도
전체 염류에서 각 염류가 차지하는 비율은 항상 일정하다는 법칙이며
해수가 오랜시간 동안 순환하며 골고루 섞이기 때문에 나타나는 현상이다.
다음과 같이 A와 B 바다의 염분과
해수 1000g 당 염화나트륨, 염화마그네슘의 질량이 각각 다른 경우에도

염분과 염화나트륨 질량, 염화마그네슘 질량의 비율은
A와 B 바다 모두 10 : 7 : 1이고
A바다의 염분과 B 바다의 염분 비
A 바다의 염화나트륨 질량과 B 바다의 염화나트륨 질량비
A 바다의 염화마그네슘 질량과 B 바다의 염화마그네슘 질량비는
모두 1 : 2로 동일하다.
예제를 풀어보며 마무리 하자.
다음과 같은 자료가 주어졌을 때

A 바다의 1kg 당 염화마그네슘의 질량 (가)와
B 바다의 염분 (나)를 염분비 일정 법칙을 이용해 구해보자.
먼저 B 바다의 염화나트륨 질량과 염화마그네슘 질량의 비율은
A 바다의 염화나트륨 질량과 염화마그네슘 질량의 비율과 같아야 하므로
비례식을 세워서 계산하면
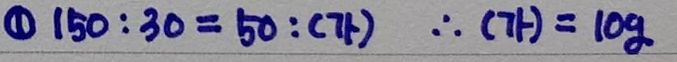
(가)는 10g 이라는 것을 알 수 있으며
A바다의 염화나트륨 질량과 B 바다의 염화나트륨 질량의 비는
A 바다의 염분과 B바다의 염분 비율과 같아야 하므로
비례식을 세워서 계산하면

(나)는 96psu라는 것을 알 수 있다.
탑사이언스 과학학원(대구 수성구)